2つの反応部位を連結して行う分子内反応では、対応する分子間反応に比較して反応効率の向上や選択性の効果的な制御が期待できます。さらに、連結部位に除去可能なボリル基やシリル基を用いることで、応用範囲の広い有効な合成戦略となります。
分子内ビスシリル化
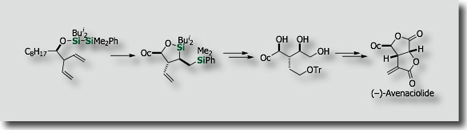
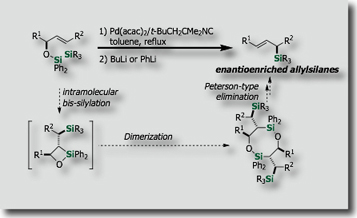
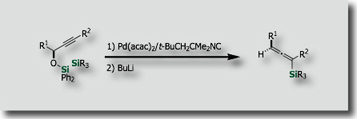
シリル基を連結部位とする分子内シリル化は、特徴ある分子変換手法となりうると考えられ、魅力的です。私たちは高い反応効率かつ高立体選択性を達成する分子内ビスシリル化を開発し、これを応用する有機合成手法を確立しました。まず、ホモアリルアルコール誘導体の立体選択的分子内ビスシリル化を鍵段階として、(–)-Avenaciolideの全合成を達成しました。[Ref. 1] また、高効率な不斉転写を伴うアリルアルコールの分子内ビスシリル化により、光学活性アリルシランを高い光学純度で合成することに成功しています。 [Ref. 2] 同様に、光学活性なプロパルギルアルコールからキラルなアレニルシランが高鏡像異性体過剰率で合成できます[Ref. 3]。
分子内シアノホウ素化
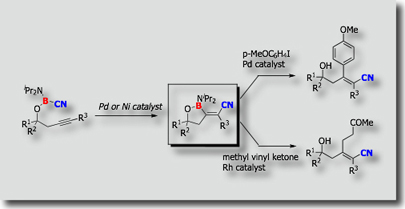
分子内ボリル化の開発にも成功しています。[Ref. 4] 一例として、分子内シアノホウ素化を示します。この反応は、対応する分子間反応よりも高い位置および立体選択性で進行します。生成物は多置換二重結合を有するα,β-不飽和ニトリルに誘導することができます。
関連研究
- トランスメタル化環化カルボホウ素化
参考文献
- Ref. 1
- Diastereoselective Intramolecular Bis-Silylation of a Carbon-Carbon Double Bond. A Highly Stereocontrolled Synthesis of (-)-Avenaciolide. M. Suginome, Y. Yamamoto, K. Fujii, Y. Ito, J. Am. Chem. Soc. 1995, 117, 9608–9609, 10.1021/ja00142a047
- Ref. 2
- New Synthesis of (E)-Allylsilanes with High Enantiopurity via Diastereoselective Intramolecular Bis-Silylation of Chiral Allylic Alcohols M. Suginome, A. Matsumoto, Y. Ito, J. Am. Chem. Soc. 1996, 118, 3061–3062, 10.1021/ja954251x
- Synthesis of Highly Enantio-enriched Allylsilanes via Palladium-catalyzed Intramolecular Bis-Silylation. Determination of the Enantiomeric Excesses through Regio- and Stereoselective Hydroboration with 9-BBN M. Suginome, T. Iwanami, A. Matsumoto, Y. Ito, Tetrahedron: Asymmetry, 1997, 8, 859-862, 10.1016/S0957-4166(97)00073-6
- Stereoselective Cyclization of Highly Enantio-Enriched Allylsilanes with Aldehydes via Acetal Formation: New Asymmetric Access to Tetrahydropyrans and Piperidines M. Suginome, T. Iwanami, Y. Ito, J. Org. Chem. 1998, 63, 6096-6097, 10.1021/jo981173y
- Asymmetric Synthesis of 2,3-Disubstituted Oxepanes via Acetalization-Cyclization of an Enantioenriched Functionalized Allylsilane with Aldehydes M. Suginome, T. Iwanami, Y. Ito, Chem. Commun. 1999, 2537-2538, 10.1039/a908603j
- Asymmetric Synthesis of Cyclic Alkenes via Cyclization of Enantioenriched Allylsilanes M. Suginome, T. Iwanami, A. Yamamoto, and Y. Ito, Synlett, 2001, 1042-1045, 10.1055/s-2001-14656
- Solid-Phase Synthesis and Asymmetric Reactions of Polymer-Supported Highly Enantioenriched Allylsilanes M. Suginome, T. Iwanami, and Y. Ito, J. Am. Chem. Soc. 2001, 123, 4356-4357, 10.1021/ja005865r
- Stereoselective Synthesis of Highly Enantioenriched (E)-Allylsilanes by Palladium-Catalyzed Intramolecular Bis-Silylation: 1,3-Chirality Transfer and Enantienrichment via Dimer Formation M. Suginome, T. Iwanami, Y. Ohmori, A. Matsumoto, Y. Ito, Chem. Eur. J., 2005, 11, 2954-2965, 10.1002/chem.200401031
- Ref. 3
- Palladium-Catalyzed Intramolecular Bis–Silylation of Propargylic Alcohols: A New Stereospecific Access to Chiral Allenylsilanes M. Suginome, A. Matsumoto, Y. Ito, J. Org. Chem. 1996, 61, 4884-4885, 10.1021/jo960778w
- Ref. 4
- Palladium- and Nickel-Catalyzed Intramolecular Cyanoboration of Alkynes M. Suginome, A. Yamamoto, M. Murakami, J. Am. Chem. Soc. 2003, 125, 6358-6359, 10.1021/ja0349195
- Synthetic Application of Intramolecular Cyanoboration on the Basis of Removal and Conversion of a Tethering Group by Palladium-Catalyzed Retro-allylation T. Ohmura, T. Awano, M. Suginome, H. Yorimitsu, K. Oshima, Synlett 2008, 423-427, 10.1055/s-2008-1032075
Last-modified: 2009-01-21 (水) 18:02:02 (5574d)