![[logo] [logo]](wiki/image/logo.png)
生体内には実に様々な分子が存在し、密に連携をとって機能を発揮しています。このような生体内で機能する分子個々の働きを解析する事ができれば、例えば記憶する時に脳で起こっている事を分子レベルで明らかにしたり、病気の原因となるタンパク質の異常な挙動を解析することにより、色々な生命現象の謎解きに貢献するだけでなく、特定の病気の診断や治療にもつながると考えられます。ただし、多くの生体分子はそのままでは見る(解析する)ことはできないので、見たい分子に何か目印を付ける必要があります。その目的でこれまでに主に使われてきたのは、GFPに代表される蛍光タンパク質を、目的の生体分子に遺伝子的に融合し細胞内で発現させる方法です。一方で、蛍光タンパク質それ自身の限界(タンパク質タグという分子サイズ、検出が蛍光モードに限られるなど)に加えて、遺伝子工学的に発現する方法は、本来そこにあった「内在性」の分子を見る事はできません。これでは、機能異常のタンパク質は見る事ができませんし、本来存在するタンパク質の定量も不可能です。もともと細胞に内在するタンパク質を標的にして、それを直接見る事はできないものか?我々は、細胞内のような夾雑な環境下で、今そこにあるタンパク質を、小分子プローブを使って化学修飾する方法に着目しています。
小分子プローブにはいくつかの利点が考えられます。まずその分子サイズが小さいため、対象タンパク質の機能を損なう事なく標識化できます。また、蛍光に限らず様々な検出モードに対応できるため、MRIやPET、PATといったより個体での検出に適したプローブを利用できます。では、このような分子をタンパク質などに修飾するにはどうすればいか?これは、甚だ困難な課題です。タンパク質だけを考えても、細胞内には非常に多種類のものが混在していて、かつそれらはほぼ同じように20種類のアミノ酸で構成されています。このような背景の中、ある特定のタンパク質の、ある特定の部分だけをラベルする手法として、我々は「リガンド指向型化学」を開発してきました。ここではリガンド指向型化学に至るまでの経緯と発展を概説します。
生体高分子の主役であるタンパク質は、生物機能のほとんどすべてを司っています。その機能は分子認識や触媒など多彩で、これを人為的に修飾・改変することにより、これまでにない新規な機能を有する人工タンパク質の創成が期待できます。これまでに我々は、タンパク質の人工機能化の例として、ヘム蛋白質の光機能化(図1)1)や外部刺激に応答する人工酵素(図2)2)などを報告しています。


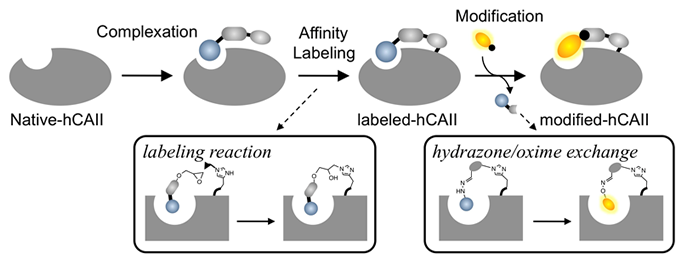
我々が天然タンパク質の人工機能化に用いた戦略は、タンパク質が本来持つリガンド認識能を利用する方法でした。この「リガンド指向型ラベル化法」は、標的タンパク質に親和性のあるリガンド分子と、タンパク質と反応しうる反応部位とを、切断や修飾可能な官能基で連結した「ラベル化剤」と我々が呼ぶ分子によって達成されます。反応部位には、ラベル化剤がタンパク質に認識され、タンパク質表面と近接した時にだけ反応するような反応基を用いれば、様々な分子が存在する中でも標的タンパク質のみをラベル化することができます。このようなラベル化法は「(光)アフィニティーラベル化法」として古くから知られていますが、従来法は、タンパク質の活性ポケットがリガンドでマスクされているため、その活性を解析したりする事は基本的にはできません。そこで我々は、リガンド部位と反応部位をジスルフィド結合、あるいはシッフ塩基結合で連結し、ラベル化後に切断する方法を開発してきました(それぞれP-PALM, P-ALM: Post-(Photo) Affinity Labeling Modificationと呼ぶ。(図3, 4)。

この技術を糖結合性タンパク質(レクチン)の1種であるCon Aに対して適用し、蛍光色素を導入することで、糖質を蛍光で読み出せる「蛍光性糖質バイオセンサー」を開発しました3)。糖質は多彩な構造をとるため、水中での認識は困難でしたが、P-PALMにより高選択的なセンサーを開発できました。またこの蛍光性糖質センサーは別の機能性分子と組み合わせることで、さらに機能が拡張できます。例えば異なる色素を内部標準として導入することで、精度の高い「レシオ型糖質センサー」を開発しました4)。このセンサーは色調の変化として糖質を読み出せるため、他成分の影響の大きい細胞内においても糖質(グルコース)の検出に成功しています(図5)。

上記の方法は全て、試験管中の精製タンパク質を用いてラベル化反応を行なった例でした。これらの方法は、アフィニティーラベル化の時点では特異的な反応が期待できますが、2段階目のプローブ導入反応において、チオール基やアルデヒド基といった細胞内にもある官能基を用いているので、細胞内での応用は困難でした。この問題を解決するために我々が考案したのは、アフィニティーラベル化に求核置換反応を利用する戦略です。この方法では、あらかじめラベル化剤にプローブ分子を組み込んでおいて、リガンドとプローブとを、有機化学で古くから利用されてきた求電子剤「トシル基」で連結します。この新しいラベル化剤を用いれば、親和性に駆動された特異的ラベル化反応の時点で、リガンド分子は同時に切り離され、望みのプローブ分子だけが標的タンパク質に共有結合で修飾されることになります。我々はこの方法、「リガンド指向型トシル化学(Ligand-directed tosyl (LDT) Chemistry)」と名付けました(図6)。

この方法の有効性を実証するために、ヒト由来炭酸脱水酵素(human Carbonic Anhydrase, hCA)を標的タンパク質として採用し、その阻害剤としてベンゼンスルホンアミドをリガンド分子に据えました。まず蛍光プローブによって、試験管での精製hCAの特異的なラベル化が確認されました。また本反応は、細胞内に高濃度存在する求核種であるグルタチオン共存下でも同様に起こることから、このラベル化剤はhCAに認識された時にだけ反応する事も示唆されました。さらに、hCAが内在的に存在する赤血球で検討を行った結果、多種類のタンパク質が共存する中でも、hCA選択的に蛍光ラベル化出来る事が明らかとなりました。また、同時に強力な阻害剤共存下では起こらない事、また反応中に細胞が溶血しない事などから、温和な条件で非常に特異的に進行することが分かりました。最後に、この特異的な反応は、マウス個体内の赤血球内CAをターゲットにした場合も同様に進行し、LDT化学は生物個体内でも、ただ1種類の標的タンパク質だけに化学修飾することのできる画期的なラベル化法であることが示されました。
我々は、LDT化学を用いたタンパク質の人工機能化も行なっています。例えば生体深部でも観測可能な19F-MRIプローブを、ヒト赤血球細胞中でhCAにラベル化する事により、19F-ラベル化hCAを細胞の中で調整して、その後そのままhCAの阻害剤結合を19F-NMRで読み出す事に成功しています。この19F-hCAはX線結晶構造解析にも成功しており、機能性分子のリガンド結合に伴う明確な環境変化が、19F-NMRのケミカルシフト変化に現れている事を分子レベルで解き明かしました。また、LDT化学はリガンド部分の入れ替えによって、他の様々なタンパク質にも展開でき、実際にリガンド部分を薬剤類似化合物SLFに変換することで、これを認識するFKBP12と呼ばれるタンパク質がラベル化できています。さらにFKBP12が内在的に発現する哺乳類細胞内でのラベル化により、光反応基を部位特異的に導入する事で、FKBP12が細胞内で相互作用するタンパク質を光クロスリンクで修飾する事にも成功しています。


リガンド指向型化学の方法論に関しては、トシル基に限らず様々な反応基へと拡充しています。この発展は、反応基によってラベル化されうるタンパク質上のアミノ酸の種類が増える事で、より一般性の高い方法論に発展される事が予想されますし、リガンド指向型化学の反応基の選別によって、反応特異性や反応速度のさらなる向上なども見込まれます。例えば我々は2012年に、トシル基に変わる新たな反応基としてアシルイミダゾール基を用い、タンパク質上でのカルバメート結合形成に成功しています。この方法は、LDT化学では効率の悪かった細胞表層のタンパク質に展開され、反応速度の速い効率的な反応である事が見いだされています。
我々は、切り離し型アフィニティーラベル化法としてのリガンド指向型化学以外に、細胞系で有効な化学的アプローチとして、タンパク質上での触媒反応という方法論を構築しています。用いたのは、エステル化触媒としてこちらも古くから有機合成で汎用される、ジメチルアミノピリジン(DMAP)による反応です。分子設計戦略としては、タンパク質に認識される小分子リガンドにDMAPを連結したリガンド連結DMAPと、DMAPに活性化されうるアシルドナーとしてチオエステル誘導体を用います。本系は、Affinity-guided DMAP Chemistry (AGD化学)と名付け、例えばレクチンや細胞表層タンパク質、特に創薬ターゲットとして注目を集めるGタンパク質共役受容体(GCPR)にも展開され、GCPRリガンドの蛍光センシングを細胞表層でも成功しています。さらに最近では、DMAPをタンパク質であるレクチンに導入し、細胞表層糖タンパク質の網羅的ラベル化にも展開する事に成功しました。


References