論文紹介
TRPA1 underlies a sensing mechanism for O2.
詳 細 へNobuaki Takahashi, Tomoyuki Kuwaki, Shigeki Kiyonaka, Tomohiro Numata, Daisuke Kozai, Yusuke Mizuno, Shinichiro Yamamoto, Shinji Naito, Ellen Knevels, Peter Carmeliet, Toru Oga, Shuji Kaneko, Seiji Suga, Toshiki Nokami, Jun-ichi Yoshida & Mori Y.
Nature Chemical Biology 7. 701-711(2011).
新たな生体内酸素センサー機構の発見
私たちヒトを含める好気性生物の生存において、「酸素(O2:分子状酸素)」は必要不可欠な物質である。しかし、同じ体内に取り込まれたO2は一部が過酸化水素や超酸化物イオンなどの活性酸素種に変化し、時として生物に対し「酸素毒性」を示す。高濃度のO2の吸引はヒトを呼吸器疾患、未熟児網膜症など、最悪の場合には死に至らしめうるのである。このようなO2が示す両義性に対応するために好気性生物は、体内に取り入れ可能なO2の分圧を感知し、組織へのO2供給を厳密に制御する仕組みを備えている。今回私たちは、イオンチャネルタンパク質TRPA1が「O2センサー」としてこの両義性に対応するために機能することを突き止めた。
TRPA1内のシステイン残基が酸化物に対して極めて高い感受性を示し、高O2濃度溶液中においてTRPA1はO2による酸化を受けて活性化・開口した。一方、TRPA1は低O2濃度溶液でも活性化・開口した。ここでは、O2濃度依存的なプロリン水酸化酵素による阻害から、TRPA1が低O2濃度で解放される機構が働いていることを発見したが、これは全く前例のない新しいイオンチャネルの活性化・開口機構を示すものである。活性化・開口したTRPA1は感覚神経細胞や迷走神経細胞などにイオン電流を生じ神経活動を引き起こした。さらに、TRPA1遺伝子欠損(TRPA1 KO)マウスにおいては、高O2及び低O2ガス吸入に伴う迷走神経の活動と、それに伴う呼吸反射が著しく損なわれていることを確認した。TRPA1 KOマウスは、通常O2濃度下において肺障害及び肺高血圧症を示すが、これらの症状は高O2及び低O2濃度両環境下では、更に重篤化することも見出した。TRPA1 KOマウスでは、生体内O2センサーとしての機能が失われているものと考察される。即ち、TRPA1が生体内のO2センサーとして機能し、O2の体内供給を厳密に制御することが示された。
今回の研究は生命活動の根幹をなすO2に対する新たな生物学的理解を与え、感覚生物学全体に飛躍的な進歩をもたらすと考える。哺乳動物、特にヒトにおいては、旧来より化学受容器の中でも頸動脈小体による動脈血中のO2分圧の感知が最重要であると考えられ、頸動脈小体のglomus細胞における様々なO2センサー機構が乱立して提案されてきた。私たちの研究は、肺や気管に感覚神経や迷走神経などが投射する化学受容器が、TRPA1を介して大気中の直接的なO2感知に果たす重要な役割を新たに示したことになる。また今回、低O2分圧のセンサーに比べると見過ごされてきた、O2毒性を避けるための高O2分圧のセンサーにも光を当てることになった。即ち、微生物、線虫、昆虫などのいわゆるより原初的な生物では広くみられる応答・行動様式である「酸素忌避」(oxygen avoidance)に準じる機能を哺乳類も備えていることを私たちの研究は示唆し、進化生物学的に非常に興味深い知見である。さらに、私たちの研究の意義として、大気中の海抜ゼロ地点におけるO2分圧変動を感知できるTRPA1のO2センサーとしての高い性能が挙げられる。この点は、通常飼育下においてTRPA1 KOマウスが示す上述の病理学的表現型が支持しており、TRPA1の微妙な狂いが神経因性疼痛や呼吸器障害など様々な疾患に関与しているとも考えられる。本研究成果は、8月28日午後1時(ニューヨーク時間)にNature Chemical Biology online版にて公開された。
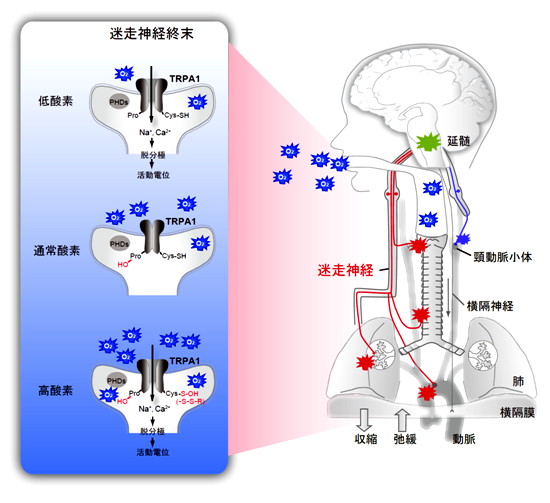
- TRPA1によるO2感知機構
RIMγ isoforms lacking the Rab3-binding domain induce long-lasting currents but block neurotransmitter vesicle-anchoring in voltage-dependent P/Q-type Ca2+ channels.
詳 細 へUriu Y, Kiyonaka S, Miki T, Yagi M, Akiyama S, Mori E, Nakao A, Beedle AM, Campbell KP, Wakamori M & Mori Y.
J. Biol. Chem. 285, 21750-21767 (2010).
Abstract
Assembly of voltage-dependent Ca2+ channels (VDCCs) with their associated proteins regulates the coupling of VDCCs with upstream and downstream cellular events. Among the four isoforms of the Rab3-interacting molecule (RIM1 to -4), we have previously reported that VDCC β-subunits physically interact with the long α isoform of the presynaptic active zone scaffolding protein RIM1 (RIM1α) via its C terminus containing the C2B domain. This interaction cooperates with RIM1α-Rab3 interaction to support neurotransmitter exocytosis by anchoring vesicles in the vicinity of VDCCs and by maintaining depolarization-triggered Ca2+ influx as a result of marked inhibition of voltage-dependent inactivation of VDCCs. However, physiological functions have not yet been elucidated for RIM3 and RIM4, which exist only as short γ isoforms (γ-RIMs), carrying the C-terminal C2B domain common to RIMs but not the Rab3-binding region and other structural motifs present in the α-RIMs, including RIM1α.
Here, we demonstrate that γ-RIMs also exert prominent suppression of VDCC inactivation via direct binding to β-subunits. In the pheochromocytoma PC12 cells, this common functional feature allows native RIMs to enhance acetylcholine secretion, whereas γ-RIMs are uniquely different from α-RIMs in blocking localization of neurotransmitter-containing vesicles near the plasma membrane. γ-RIMs as well as α-RIMs show wide distribution in central neurons, but knockdown of γ-RIMs attenuated glutamate release to a lesser extent than that of α-RIMs in cultured cerebellar neurons. The results suggest that sustained Ca2+ influx through suppression of VDCC inactivation by RIMs is a ubiquitous property of neurons, whereas the extent of vesicle anchoring to VDCCs at the plasma membrane may depend on the competition of α-RIMs with γ-RIMs for VDCC β-subunits.
γ-RIMs as well as α-RIMs show wide distribution in central neurons, but knockdown of γ-RIMs attenuated glutamate release to a lesser extent than that of α-RIMs in cultured cerebellar neurons. The results suggest that sustained Ca2+ influx through suppression of VDCC inactivation by RIMs is a ubiquitous property of neurons, whereas the extent of vesicle anchoring to VDCCs at the plasma membrane may depend on the competition of α-RIMs with γ-RIMs for VDCC β-subunits.
電位依存性Ca2+チャネル(VDCC)を中心とした分子複合体の集積は、VDCCと、その上流もしくは下流の細胞イベントの共役を制御している。我々は、近年、Rab3-interacting molecule(RIM1-4)の4種類のアイソフォームのうち、プレシナプスアクティブゾーンの足場タンパク質として知られるα型のRIM1が、C2Bドメインを含むC末端領域を介して、VDCCのβサブユニットと、物理的に結合することを明らかにした。この相互作用はRIM1αとRab3の相互作用と協調的に働いてシナプス小胞をVDCC近傍に繋ぎ止め、VDCCの不活性化を阻害することで、アクティブゾーンにおける効率的な伝達物質放出を可能にする。しかし、短いγ型しか存在しないRIM3やRIM4は、C2Bドメイン以外のα型に見られるRab3結合領域等の構造モチーフをもたず、生理的機能は不明なままであった。
我々は、γ-RIMもβサブユニットとの直接結合によって、VDCCの不活性化を阻害することを明らかにした。神経様細胞であるPC12細胞において、このRIMファミリー共通の機能がアセチルコリン放出を正に制御する一方で、γ-RIMは神経伝達物質を含む小胞の細胞膜直下への局在を阻害した。γ-RIMの発現抑制は、α-RIMの発現抑制ほどには、小脳顆粒細胞からのグルタミン酸放出を抑制しなかった。γ-RIMはα-RIMと同様に中枢神経において広範な分布を示したが、これらの結果は、神経細胞においてRIMによるVDCCの不活性化の阻害が普遍的である一方で、VDCC近傍へのシナプス小胞のアンカリングは、α-RIMとγ-RIMが競合的にVDCCのβサブユニットとの複合体を形成することによって制御されていることを示唆する。
Ca2+ influx and protein scaffolding via TRPC3 sustain PKCβ and ERK activation in B cells.
詳 細 へNumaga T, Nishida M, Kiyonaka S, Kato K, Katano K, Mori E, Kurosaki T, Inoue R, Hikida T, Putney Jr JW & Mori Y.
J. Cell Sci. 123, 927-938 (2010).
Selective and direct inhibition of TRPC3 channels underlies biological activities of a pyrazole compound.
詳 細 へKiyonaka S, Kato K, Nishida M, Mio K, Numaga T, Sawaguchi Y, Yoshida T, Wakamori M, Mori E, Numata T, Ishii M, Takemoto H, Ojida A, Watanabe K, Uemura A, Kurose H, Morii T, Kobayashi T, Sato Y, Sato C, Hamachi I & Mori Y.
Proc. Natl. Acad. Sci. USA 106, 5400-5405 (2009).
TRPM2-mediated Ca2+ influx induces chemokine production in monocytes that aggravates inflammatory neutrophil infiltration
詳 細 へYamamoto S, Shimizu S, Kiyonaka S, Takahashi N, Wajima T, Hara Y, Negoro T, Hiroi T, Kiuchi Y, Okada T, Kaneko S, Lange I, Fleig A, Penner R, Nishi M, Takeshima H & Mori Y.
Nature Med. 14, 738-747 (2008).

