Current Research †Protein Sensing Group (小分子・タンパク質可視化プローブの開発) †Protein Sensing Grでは、2つの目標にむかった研究をおこなっています。1つ目は、生体において重要な役割を果たしているリン酸アニオン誘導体の機能解明を目指した分子ツールの開発。2つ目は、生体機能において重要な役割を果たしているタンパク質の機能解明を目指したタンパク質標識システムの開発です。この2つの目標に対して、私たちは分子認識化学を基盤として、研究を展開していっています。 リン酸アニオン誘導体の蛍光センシングを指向した新規分子ツールの開発 †生体機能の調整において、タンパク質の翻訳後修飾であるリン酸化・脱リン酸化(図1)は極めて重要な役割を果たしています。私たちのグループでは、リン酸アニオン誘導体の認識にDpa/Znの金属配位子相互作用(配位化学)を利用することを見いだし、リン酸アニオンを選択的に認識し蛍光センシングすることに世界で初めて成功しました(図2)。このリン酸アニオンの蛍光センシング能を利用することで、リン酸化タンパク質の蛍光検出(図3 ・図4・図6)や脱リン酸化酵素反応のリアルタイム蛍光モニタリング(図5)などに成功しています。 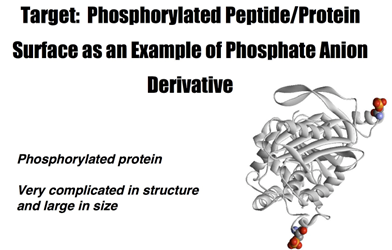 図1. 生体機能において重要な役割を果たしているリン酸化タンパク質
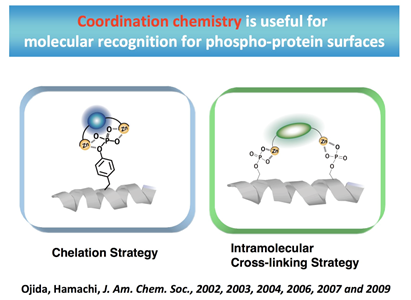 図2. 配位化学を利用したリン酸化タンパク質表面の認識
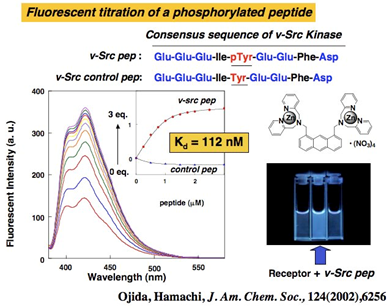 図3. アントラセン型レセプターによるリン酸化ペプチドの選択的蛍光センシング
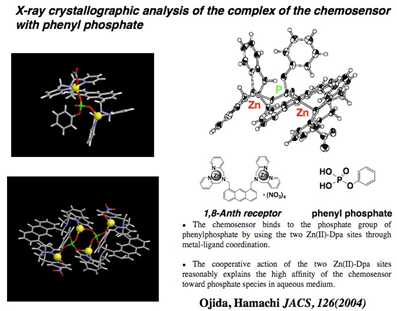 図4. アントラセン型レセプターとフェニルリン酸との結合状態の結晶構造解析
 図5. アントラセン型レセプターによる、脱リン酸化酵素反応のリアルタイム蛍光モニタリング
 図6. リン酸化タンパク質簡易検出のための電気泳動ゲル蛍光染色キットとして市販
タンパク質の翻訳後修飾であるリン酸化には、タンパク質表面の複数の残基がリン酸化される多点リン酸化(ハイパーリン酸化)という現象がみられます。私たちは、このような多点リン酸化タンパク質の認識を、リン酸化部位間の距離による配列選択能を付与することで、多点リン酸化タンパク質の検出にも成功している(図2)。その1例として、アルツハイマー病発症に関与する異常リン酸化タウタンパク質を選択的に認識し蛍光センシングすることにも成功しています(図7、8)。 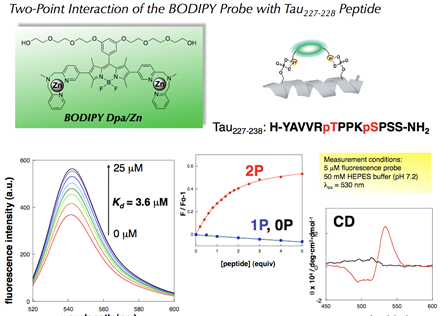 図7. 架橋型センサー分子による多点リン酸化タンパク質の蛍光検出
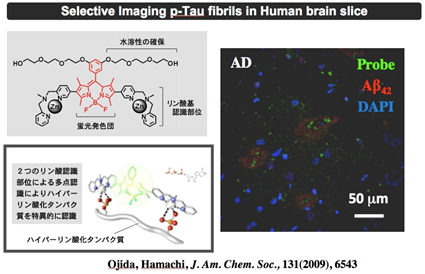 図8. 脳切片を用いたリン酸化タウタンパク質凝集体の蛍光イメージング
その他の多点リン酸化タンパク質へのアプローチとして、リン酸化部位を認識するドメインの1つであるWWドメインと、私たちの開発したセンサーユニットをハイブリッドさせることで、天然のリン酸化タンパク質認識ドメインのもつ認識能を利用したハイブリッド型バイオセンサーの開発にも成功している(図9)。 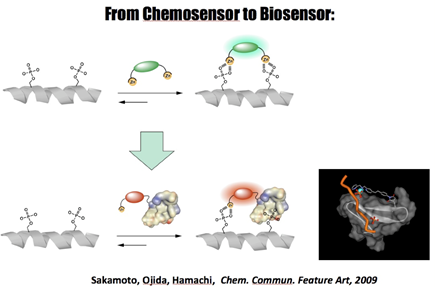 図9. 人工の認識ドメインと天然の認識ドメインとのハイブリッド型バイオセンサー
タンパク質のリン酸化・脱リン酸化以外にも、ATPなどのリン酸誘導体はエネルギー源やシグナル伝達物質として重要です(図10)。私たちは、そのようなリン酸誘導体に対してもDpa/Znの金属配位子相互作用(配位化学)を利用する蛍光センサー分子の開発を行ってきています。実際に、これまでに様々な蛍光特性を有するセンサー分子を開発してきました。中でも、アクリジン(図11,12)やキサンテン(図13,14)を蛍光団として利用したセンサーは、リン酸誘導体の認識に伴い大きく蛍光波長変化や蛍光強度変化を示すといった特異な蛍光検出メカニズムを発見できています。これらの蛍光センサー分子を用いることで、リン酸誘導体が関与する重要な酵素反応の1つである、糖転移酵素のリアルタイムでの酵素活性の評価(図12)や、細胞内に存在するATP顆粒の可視化(図14)などに成功しています。  図10. 生体内には様々な役割をもつリン酸誘導体が存在
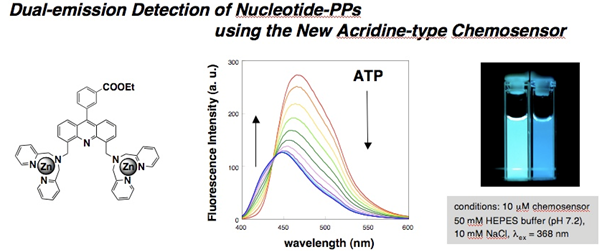 図11. アクリジン型センサー分子の蛍光波長変化を用いた高精度センシング
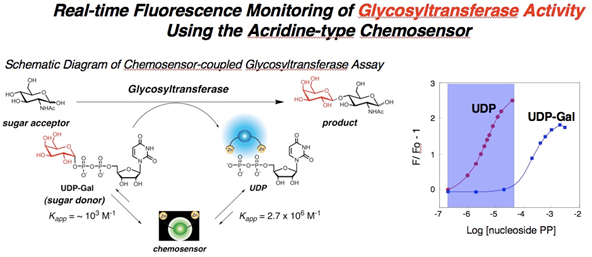 図12. アクリジン型センサー分子による糖転移酵素反応のリアルタイム蛍光モニタリング
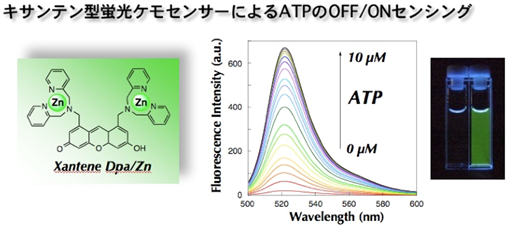 図13. キサンテン型センサー分子によるリン酸誘導体の蛍光OFF/ONセンシング
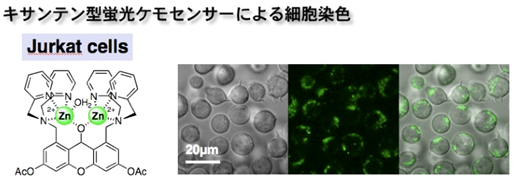 図14. キサンテン型センサー分子によるJurkat細胞内のATP顆粒の検出
タンパク質機能解明へ向けた新規ペプチドタグシステムの開発 †1.研究背景 †多様化するタンパク質研究において、蛍光プローブやアフィニティタグなどの機能性分子をタンパク質に部位特異的に標識する手法の開発は必要不可欠である。タンパク質を特異的に標識可能になることで、生体機能の解明、病態・疾病の発症機能解析や、新しい治療薬開発への応用へとつながる。一方で、タンパク質を対象とした修飾・機能改変をおこなう際に使用可能な手法は限られているのが現状である。そのような背景から、当研究室では様々なタンパク質標識のためのアプローチがなされている。 2.新規ペプチドタグープローブペアの開発とバイオイメージングへの応用 †細胞内におけるタンパク質の動態や局在をリアルタイムに蛍光可視化するバイオイメージングは生体機能の解明に不可欠な技術となっている(図1)。バイオイメージングにおいては、標的タンパク質の選択的な蛍光標識技術が必須であり、そのための新しい技術として『ペプチドタグ / 小分子プローブ』ペアを用いた標識法の研究をおこなっている。この標識手法は、天然には稀なアミノ酸配列を『ペプチドタグ』として標的タンパク質に遺伝子レベルで導入して発現させ、これと特異的に相互作用可能な小分子蛍光プローブによって蛍光標識するものである(図2)。この手法は、遺伝子工学に基づく高い汎用性と、化学的なツールを容易に導入可能であるといった利点を有する。 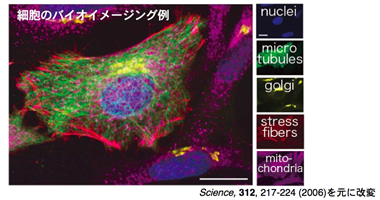 図1. 細胞のバイオイメージング例
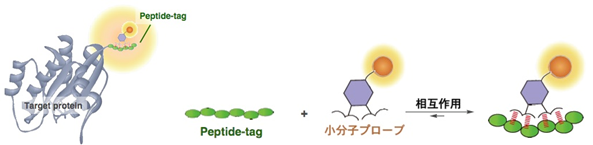 図2. 『ペプチドタグ / 小分子プローブ』ペアによるタンパク質標識法
当研究室では、チロシンを基本骨格とした二核亜鉛(II)錯体 (Zn(II)-DpaTyr) が4連続アスパラギン酸 (D4-tag ; DDDD) と強い親和性を示すことを見出した(図3)。さらに相互作用部位を倍化させた Zn(II)-DpaTyr 錯体ダイマーではマルチバレント効果により連続D4タグ ((D4)2-tag ; DDDD-G-DDDD) とKd = 55 nM という高い結合能が得られることを明らかとした(図4)。 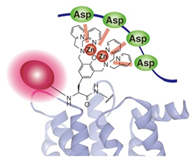 図3. 『D4タグ / Zn(II)-DpaTyr』
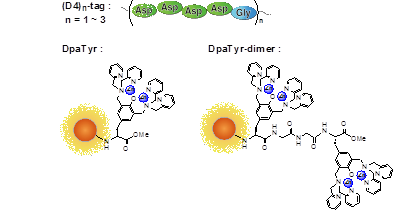 図3. D4タグ-DpaTyrプローブペアの構造
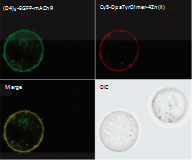 図4. Cy5-DpaTyrDimer-4Zn(II)
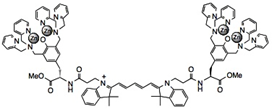 図5. Cy5-DpaTyrDimer-4Zn(II)および(D4)3-EGFP-mAChRを用いた共染色実験模式図
参考文献 3.「D4/DpaTyr-2Zn(Ⅱ)」ペアを用いたタンパク質の蛍光波長変化型センシング †前節で紹介した「D4/DpaTyr-2Zn(Ⅱ)」ペアを用いることで、標的タンパク質のみを選択的に蛍光検出することも可能である。例えば、(D4)2-tagを導入したタンパク質((D4)2-tag RNase)に対して蛍光色素としてpH応答性蛍光色素であるSNARFを導入したSNARF-DpaTyr-2Zn(Ⅱ)を用いた場合、(D4)2-tag RNaseを選択的に認識すると同時に、蛍光波長が長波長側に変化する蛍光レシオ型の機能を付与することが出来た(図6)。 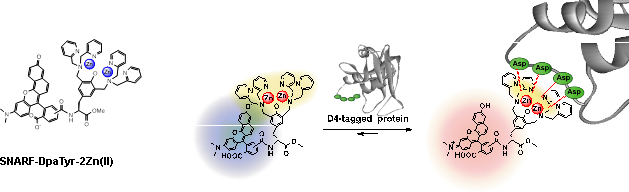 図6. SNARF-DpaTyr-2Znを用いたタグつきタンパク質の波長変化型センシング
また、蛍光色素としてPyreneを用いたPyrene-DpaTyr-2Zn(Ⅱ)を加えた場合でも、(D4)2-tag RNaseのみを、Pyreneのエキサイマー蛍光によって目視で検出することに成功した。これは2つのプローブがそれぞれタグ配列中の2カ所のD4部位に配位することに伴いPyreneのエキサイマー蛍光を発することを利用している。なお本研究の成果は、英文誌「ChemBioChem」の表紙に採用された。 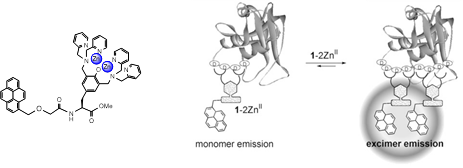 図7. Pyrene-DpaTyr-2Znを用いたタグつきタンパク質の波長変化型センシング
参考文献 4.新規共有結合型ペプチドタグシステム『リアクテリブタグシステム』によるタンパク質の化学修飾 †前節までに紹介した配位化学によるラベル化システムでは、分子認識のみに選択性を頼っていたために、目指すべき生体システムのような夾雑系への適用では、選択性・結合の安定性に改善が必要であった。そこで、我々はこれまでの配位化学による標識法を拡張し、1)分子認識化学による選択性に加えて、2)反応性アミノ酸への化学修飾反応の選択性を組み合わせることで、高い選択性と強固な共有結合を合わせ持つタンパク質修飾技術『Reactive Tag System』を開発した(図8)。 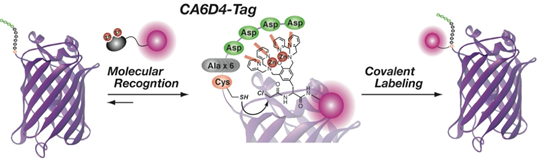 図8. Reactive Tag Systemによる共有結合形成型のタンパク質修飾
参考文献 |
添付ファイル:
View Edit
![[logo] [logo]](wiki/image/logo.png)